¿DE QUÉ ESTÁ HECHA LA MATERIA? LA MATERIA Y SUS PROPIEDADES GENERALES Y ESPECÍFICAS
Todos los cuerpos del Universo están formados por materia. Ejemplos de sistemas materiales son el aire de un globo, el agua en un vaso, un tronco de madera, un trozo de hierro, un puñado de arena, etc.
Pero, ¿qué es la materia?
El aceite, el oxígeno, una roca de magnetita, son cuerpos materiales. Sin embargo el calor, el frió, el sonido, el sabor, no son elementos materiales.
Masa y volumen son las propiedades generales necesarias para poder hablar de materia. Se puede definir como materia todo lo que tiene masa y ocupa un lugar en el espacio. Es decir, la materia es todo aquello que presenta masa y volumen.
La masa se define como la cantidad de materia de un cuerpo. Su unidad de medida es el kg.
El volumen se define como el espacio que ocupa un cuerpo. Su unidad de medida es el m3.
Por tanto, los sólidos, los líquidos y los gases son materia. Todos ellos tienen masa y ocupan un volumen.
Diferentes elementos materiales: solido, líquido y gas.
Definiciones:
Materia: todo aquello que tiene masa y ocupa un espacio.
Sistema material: porción de materia considerada de forma aislada para su estudio (por ejemplo, el gas contenido dentro de un globo, un cubito de hielo, un trozo de hierro, etc.)
Sustancia: tipo concreto de materia de la que está formada un determinado cuerpo.
PROPIEDADES DE LA MATERIA.
La materia presenta diferentes propiedades, que se clasifican en generales (intensivas) y específicas (extensivas).
Propiedades generales (intensivas) de la materia: son propiedades que dependen de la cantidad de materia considerada. Las presentan cualquier materia o sustancia, y no sirven para diferenciar unas sustancias de otras. Ejemplos de propiedades generales son masa, volumen, peso, longitud, etc.
Ejemplo: la masa es una propiedad general, y no permite diferenciar sustancias: se pueden tener 5 Kg de hierro y 5Kg de hielo. La densidad es una propiedad específica, permite diferenciar sustancias: la densidad del aluminio es 2,7 gr/cm3, mientras que la densidad del mercurio es de 13
gr/cm3
MASA.
Se llama masa a la cantidad de materia que tiene un cuerpo. Su unidad en el S.I. es el kilogramo (kg).
La masa de un cuerpo permanece siempre igual, sin importar su temperatura ni cambios en su estado físico o su forma geométrica.
La masa se mide con la balanza, instrumento que compara la masa del cuerpo a medir con la unidad de masa (1 Kg).
MASA Y PESO.
Hablando con propiedad, hay que distinguir entre masa y peso. Masa es una medida de la cantidad de materia de un objeto; peso es una medida de la fuerza gravitatoria que actúa sobre el objeto.
Masa y fuerza gravitatoria (peso) están íntimamente relacionadas. El científico inglés Newton demostró que dos cuerpos cualesquiera ejercen entre sí una fuerza de atracción, de forma que el valor de dicha fuerza depende de la distancia entre ellos (a más distancia menos fuerza) y de la masa de cada uno (a más masa más fuerza).
Una característica de la fuerza gravitatoria entre dos cuerpos es que, en muchos casos, tiene un valor tan pequeño que resulta inapreciable, a no ser que al menos uno de los dos cuerpos tenga una masa enorme.
Pues bien, el peso es la fuerza gravitatoria con la que la Tierra atrae a cualquier cuerpo que se encuentre sobre ella, o a una determinada distancia (altura) de ella. Recordar que el peso será mayor cuanto mayor sea la masa del cuerpo, pero menor cuanto más alejado se encuentre el cuerpo de la superficie terrestre.
Por ello, y al contrario de lo que sucede con la masa, el peso de un cuerpo no es constante, sino que depende de su ubicación y distancia (por ejemplo, aunque la masa de un cuerpo es siempre la misma, el peso de ese cuerpo en la superficie de la Tierra no será igual al peso de ese mismo cuerpo en órbita alrededor de la Tierra, ni igual al peso de dicho cuerpo en Júpiter).
¿Cómo se calcula el peso de un cuerpo?
P = m · g
, siendo m es la masa del cuerpo cuyo peso se quiere calcular, y g = (G · M) / d2 la aceleración de la gravedad (G es la constante de gravitación universal (6,674 · 10-11 N·m2/Kg2), M la masa del cuerpo de mayor masa, y d la distancia entre las dos masas). En el caso del planeta Tierra, toma un valor de g = (G · MT) / RT2 = 9,8 m/s2. El peso es una fuerza, y como toda fuerza se mide en Newtons (N).
Para medir el peso de un cuerpo se utilizan unos instrumentos de medida llamados dinamómetros. Un dinamómetro es esencialmente un muelle situado sobre una escala calibrada que indica el peso en Newtons. Al colgar un objeto del muelle, éste se alargará más o menos dependiendo del peso del objeto.
VOLUMEN.
Volumen es la cantidad de espacio que ocupa un cuerpo. La unidad de volumen en el S.I. es el metro cúbico (m3).
Al contrario que ocurría con la masa, el volumen de los cuerpos no permanece siempre constante:
1) El volumen de los sólidos y los líquidos depende de la temperatura.
Si la temperatura aumenta, los sólidos y los líquidos se dilatan; es decir, aumenta su volumen.
Si la temperatura disminuye, los sólidos y los líquidos se contraen; es decir, disminuye su volumen.
2) El volumen de los gases está muy fuertemente influenciado por la temperatura y la presión, y obedece unas leyes muy concretas (leyes de los gases ideales).
NOTA: Volumen y capacidad.
Volumen es el espacio que ocupa un cuerpo, mientras que capacidad el espacio vacío en un cuerpo (recipiente) que es necesario para contener una determinada sustancia u otros cuerpos. Así, el volumen de un vaso de cristal no viene dado por lo que cabe en el mismo (su capacidad), sino por el espacio que ocupa dicho cristal.
Sin embargo, volumen y capacidad están íntimamente relacionados, y las equivalencias entre sus unidades son:
DENSIDAD.
Se define densidad (ρ) como la cantidad de masa presente en una sustancia por unidad de volumen en esa misma sustancia.
La masa y el volumen son propiedades generales de la materia, por lo que su valor sólo depende de la cantidad de sustancia tomada. Es decir, toda sustancia tiene masa y volumen, y pueden tomar cualquier valor, por lo que no son propiedades que permitan diferenciar unas sustancias de otras.
Ejemplos:
Hablando de masa, se puede tener una masa de 10 kg de mercurio y una masa de 10 kg de aire. De igual forma se pueden tener 20 kg de aluminio, igual que se pueden tener 500 kg de aluminio.
Para el volumen ocurre igual, se puede tener un volumen de 1 m3 de agua, y un volumen de 1 m3 de plomo. Así mismo puede haber 5 m3 de hidrógeno o 250 m3 de hidrógeno.
Sin embargo, la materia también presenta propiedades específicas, que toman valores concretos y específicos en función de la sustancia considerada.
Por todo ello, las propiedades específicas de la materia permiten diferenciar unas sustancias de otras, ya que toman un valor característico para cada sustancia o material determinado. Así, un punto de fusión de 960 ºC indica que el material es plata, mientras que un punto de fusión de 240 ºC corresponde al estaño.
Existen muchas propiedades específicas, tales como conductividad eléctrica, elasticidad, dureza, conductividad térmica, etc. En este tema nos centraremos únicamente en una de las más importantes: la densidad.
Actividades “propiedades de la materia”
RESPONDE:
1) ¿Se puede diferenciar una sustancia de otra midiendo su masa? ¿Y conociendo su volumen? ¿Y conociendo su dureza y conductividad?
2) Se somete a un mismo trozo de aluminio a los siguientes procesos: Calentarlo hasta que se haga totalmente líquido Pulverizarlo Colocarlo en órbita en el espacio Partirlo en dos pedazos iguales y dejar sólo uno de ellos. Llevarlo a Marte en una sonda espacial
¿En cuál o cuáles de los anteriores procesos variará su masa?
3) ¿Cuál es tu masa? ¿Y cuál es tu peso?
4) Señalad si las siguientes cuatro proposiciones son verdaderas (V) o falsas (F), explicando por qué.
a) 1 kg de plomo pesa más que 1 kg de paja
b) El peso se mide en kg
c) En el vacío los cuerpos no pesan.
d) Dentro del agua se pesa menos que fuera.
5)Expresad en litros: 1200 cm3; 1 m3; 250 mL. Expresad en cm3: 0’5 L; 1 m3; 2 dm3
Estructura del átomo
La materia se clasifica en sustancias puras y mezclas, todas estas sustancias están formadas por átomos los distintos materiales existentes en la naturaleza están formados por ellos. Los antiguos pensadores o filósofos se hicieron varios interrogantes tales como: ¿de qué está hecha la materia? ¿A qué se deben las distintas propiedades de las sustancias? entre otras.
Para resolver estos interrogantes, los griegos Leucipo y Demócrito, en los siglos IV y V a C., dieron respuestas a estas primeras preguntas utilizando la especulación y el razonamiento pero no la experimentación. Llegaron a concluir que la materia está constituida por partículas pequeñísimas llamadas átomos, palabra que en griego significa indivisible.
El átomo es la partícula más pequeña de un cuerpo que conserva las propiedades de éste. La materia está constituida por átomos los cuales pueden unirse para formar moléculas.
Esta concepción de la materia fue complementada por Aristóteles en el año 384 a.C., quien sostuvo que la materia podía subdividirse indefinidamente. Estas ideas fueron retomadas 2.000 años después, cuando la experimentación hizo parte fundamental del estudio de la física y la química.
Desde entonces se han adelantado innumerables trabajos e investigaciones sobre la estructura de la materia. Científicos como John Dalton, J. J. Thomson, los esposos Curie, Rutherford, Niels Bohr, James Chadwick, entre otros, son los investigadores que dedicaron muchos años de estudio tratando de establecer
la estructura de la materia. Veamos sus principales aportes:
• En el siglo XVIII, un inglés llamado John Dalton (1767 –1844) propuso la primera teoría atómica y ordenó los átomos en una tabla de acuerdo con sus pesos atómicos.
Esta teoría está basada en la experimentación y en los conocimientos químicos que en esa época se tenían. Los postulados de Dalton siguen teniendo validez, a pesar de que se les han hecho algunas modificaciones debido a los continuos avances de la ciencia.
TEORÍAS ATÓMICAS
La teoría de Dalton
La teoría de Dalton, propuesta en 1808, se basa en los siguientes postulados:
1. Los elementos están constituidos por partículas pequeñísimas llamadas átomos, los cuales son indivisibles e indestructibles en los cambios químicos.
2. Todos los átomos de un mismo elemento son iguales.
3. Los átomos de un elemento específico son diferentes a los átomos de cualquier otro elemento.
4. Cuando dos o más elementos se combinan en forma química, los átomos de dichos elementos se unen para formar compuestos. El compuesto que se forma, siempre tiene el mismo número y tipo de átomos. Por ejemplo, la molécula del agua siempre tendrá dos átomos de hidrógeno y un átomo de oxígeno.
5. Los átomos de un mismo elemento pueden combinarse en proporciones diferentes para formar compuestos diferentes. Por ejemplo, dos átomos de hidrógeno se unen con un átomo de oxígeno para formar una molécula de agua, que se denota como H2O y dos átomos de hidrógeno se combinan con dos átomos de oxígeno para
formar una molécula de peróxido de hidrógeno que se denota como H2O2 y que se conoce como agua oxigenada.
ACTIVIDAD
De manera individual desarrolla en tu cuaderno la siguiente actividad:
1. Ver los dos vídeos, (átomos 1 y 2), hacer un resumen y escribir 5 preguntas que puedas responder con los vídeos.
2. Elabora un dibujo en la que representes un átomo que contenga ocho protones, ocho neutrones y ocho electrones.
3. Presenta la maqueta ante tu profesor y compañeros para algunos de los modelos atómicos utilizando material reciclado o elabora la estructura de una molécula poliatómica con balinera (como un spineer)
3. Explica qué importancia tiene para el ser humano el conocimiento de la estructura de la materia.
EL ÁTOMO Y LAS MOLÉCULAS
Todas las cosas que nos rodean están formadas por átomos, los cuales, como ya sabemos, son pequeñas partículas que no pueden observarse a simple vista. Ninguna persona ha observado un átomo, sin embargo, gracias a sus manifestaciones y los experimentos de algunos investigadores pueden deducirse su estructura y comportamiento.
Cuando los átomos se unen forman unidades mayores que se conocen como moléculas. La molécula es la parte más pequeña de una sustancia que puede existir en estado libre sin perder sus características. Una molécula puede estar formada por un solo átomo, por ejemplo: el argón (Ar), kriptón (Kr), entre otros. Se conoce como atomicidad de una molécula al número de átomos que constituyen la molécula y se le nombra de acuerdo con el número de átomos que presenta.
De acuerdo al número de átomos que conforman las moléculas, éstas se clasifican en monoatómicas, diatómicas, triatómicas y poliatómicas.
La molécula
Molécula monoatómica: Se denominan monoatómicas cuando la molécula está formada por un solo átomo, por ejemplo el neón (Ne) y el argón (Ar). Las moléculas formadas por un solo átomo como las de los metales, tanto el átomo como la molécula se representan de la misma manera; por ejemplo: aluminio (Al), oro (Au), cobre (Cu), entre otras.
Molécula diatómica: Se denominan diatómicas cuando la molécula está formada por la unión de dos átomos, entre ellas encontramos la molécula de oxígeno (O2) y el monóxido de carbono (CO).
Molécula triatómica: Se denomina así a las moléculas formadas por la unión de tres átomos; un ejemplo es el agua (H2O), formada por la unión de dos átomos de hidrógeno y un átomo de oxígeno.
Molécula poliatómica: Las moléculas de este tipo se forman por la unión de tres o más átomos, como es el caso del compuesto conocido como ácido sulfúrico (H2SO4).
Los átomos que forman una molécula pueden ser del mismo elemento; por ejemplo: la molécula de oxígeno (O2) o la de hidrógeno (H2); o de diferentes elementos como las moléculas de los compuestos químicos como el agua (H2O) y el dióxido de carbono (CO2).
Número atómico (Z)
Es el número de protones que se encuentran en el núcleo, se designa con la letra Z. Por ejemplo, el número atómico del carbono es 6 (Z = 6); el del hidrógeno es 1 (Z = 1); el del sodio es 11 (Z = 11).
Número de masa atómica (A)
Es la suma del número de protones (Z) y neutrones (N) presentes en el núcleo atómico, se representa con la letra A. La ecuación matemática para calcular el número de masa atómica se representa de la siguiente manera:
Número de masa atómica = Número de protones + Número de neutrones
A = Z + N
Masa atómica
Para facilitar el manejo de los valores de las masas atómicas, se estableció una unidad de masa, mucho más pequeña que el gramo y se le dio el nombre de unidad de masa atómica (uma), que se define como la doceava parte de la masa de un átomo de carbono 12. Es decir que el átomo de carbono tiene una masa de 12 uma.
En esta escala, por ejemplo, la masa atómica del hidrógeno es 1 uma y del oxígeno 16 uma. Las masas atómicas de los diferentes átomos se encuentran registradas en los textos y en las tablas periódicas.
Masa molecular
Es la suma de las masas atómicas de cada uno de los átomos que componen una molécula de un elemento o de un compuesto.
EL
NÚMERO ATÓMICO
Un criterio de organización de los
elementos de la tabla periódica es el número atómico, el cual corresponde
al número de electrones y de
protones que tiene cada elemento.
Un átomo tiene normalmente el mismo
número de electrones y de protones. Así, por ejemplo, el átomo de hidrógeno se
representa como H, tiene un protón en su núcleo y un electrón girando a su
alrededor. Por otra parte, el átomo de helio tiene dos electrones girando
alrededor de este.
Al número de protones de un átomo
se le denomina número atómico (Z), por lo que cada elemento tiene su número
atómico único.
El número de electrones y de
neutrones de un átomo puede variar y sigue siendo el mismo átomo; pero si cambia
el número de sus protones cambia totalmente dicho átomo.
HISTORIA DE LA TABLA
PERIÓDICA
En 1860 los
científicos ya habían descubierto más de 60 elementos diferentes y habían
determinado su masa atómica. Notaron que algunos elementos tenían propiedades
químicas similar por lo cual le dieron un nombre a cada grupo de elementos
parecidos.
En 1829 el
químico J.W. Döbenreiner organizó un sistema de clasificación de elementos en
el que éstos se agrupaban en grupos de tres denominados triadas. La propiedades
químicas de los elementos de una triada eran similares y sus propiedades
físicas variaban de manera ordenada con su masa atómica.
Algo más tarde,
el químico ruso Dmitri Ivanovich Mendeleyev desarrolló una tabla periódica de
los elementos según el orden creciente de sus masas atómicas. Colocó lo
elementos en columnas verticales empezando por los más livianos, cuando llegaba
a un elemento que tenía propiedades semejantes a las de otro elemento empezaba
otra columna.
Al poco tiempo
Mendeleiev perfecciono su tabla acomodando los elementos en filas horizontales.
Su sistema le permitió predecir con bastante exactitud las propiedades de
elementos no descubiertos hasta el momento. El gran parecido del germanio con
el elemento previsto por Mendeleyev consiguió finalmente la aceptación general
de este sistema de ordenación que aún hoy se sigue aplicando. Sin embargo, la
tabla de Mendeleiev no era del todo correcta. Después de que se descubrieron
varios elementos nuevos y de que las masas atómicas podían determinarse con
mayor exactitud, se hizo evidente que varios elementos no estaban en el orden
correcto. La causa de este problema la determinó el químico inglés Henry
Moseley quien descubrió que los átomos de cada elemento tienen un número único
de protones en sus núcleos, siendo el número de protones igual al número
atómico del átomo.
Al organizar
Moseley los elementos en orden ascendente de número atómico y no en orden
ascendente de masa atómica, como lo había hecho Mendeleiev, se solucionaron los
problemas de ordenamiento de los elementos en la tabla periódica. La
organización que hizo Moseley de los elementos por número atómico generó un
claro patrón periódico de propiedades.
UBICACIÓN DE LOS ELEMENTOS EN LA TABLA PERIÓDICA
PERÍODOS
Y GRUPOS DE LA TABLA PERIÓDICA
Los elementos se ordenan en la tabla periódica de
acuerdo con sus números atómicos, desde el número 1, que corresponde al
hidrógeno (H), hasta el 118, que es para el meitnerio (Mt); al hacer el
ordenamiento se forman filas horizontales y columnas verticales. A las filas
horizontales se les llama períodos y se les designa con números el 1 al 7 o con
las letras K, L, M, N, O, P y Q. Los elementos que los forman están acomodados en orden creciente de su número atómico. En los periodos se acomodan los átomos que tienen el mismo número de niveles de energía.
Cada período o nivel de energía se caracteriza por permitir un número máximo de electrones y se determina con la fórmula 2(n)2, donde n = nivel de energía. Además se debe tener presente que el último nivel de energía de un átomo no podrá contener
más de ocho electrones.
El término grupo representa los elementos de una columna vertical de la tabla. Existen dieciséis grupos, de los cuales siete se representan con los núme ros romanos I, II, III, IV, V, VI, VII y van acompañadas de la letra (A); a una octava VIII se le representa con el número cero (0) y no se le escribe la letra (A).
Los otros ocho grupos se representan con los números romanos I, II, III, IV, V, VI, VII y la letra (B), exceptuando la familia VIII, a la cual no se le acompaña con la letra B. Actualmente, para evitar las confusiones de A y B, los grupos se numeran del 1 al 18.
Los elementos de un grupo son similares en propiedades físicas y químicas. De acuerdo con estas propiedades, en algunos casos los grupos reciben un nombre particular, o bien, el nombre de uno de los elementos que la constituyen. El grupo de los gases raros o inertes cuenta con elementos bastante conocidos, tal es el caso del helio (He), el cual es utilizado para inflar los globos que flotan en el aire, el neón, el mismo con el que se llenan tubos de vidrio utilizados para anuncios luminosos.
Configuración electrónica
Según la teoría atómica actual, los electrones de un átomo se organizan alrededor del núcleo en órbitas o niveles, los cuales corresponden a regiones de espacio en las que existe una alta probabilidad de hallar o encontrar un electrón. Cada nivel se puede subdividir en subniveles. A la representación de la forma cómo se distribuyen los electrones en los distintos subniveles de energía se llama configuración electrónica de un átomo.
De esta distribución depende gran parte de las propiedades físicas y todas las propiedades químicas del átomo. La distribución de los electrones se fundamenta en los siguientes principios.
REGLAS PARA REPRESENTAR LA DISTRIBUCIÓN DE ELECTRONES DE UN ÁTOMO
Para representar la distribución de los electrones de un átomo, se usa la notación electrónica o espectral,
siguiendo las siguientes pautas:
Se escribe como coeficiente el número que representa el número cuántico principal (n): 1, 2, 3, 4, 5, 6 o 7.
Inmediatamente después, se escribe en minúscula la letra que identifica el subnivel, número cuántico
secundario (l): s, p, d o f.
Por último, se escribe en la parte superior derecha de la letra que identifica el subnivel, el número que
indica la cantidad de electrones que están presentes en el subnivel.
Para escribir la configuración espectral de un átomo es necesario:
Conocer el número atómico (número total de electrones del átomo).
Recordar que existen 7 niveles y que el número de electrones por nivel se calcula a través de la fórmula
X = 2n2.
Tener en cuenta que los electrones ocupan los subniveles siguiendo un orden creciente de energía y
que solo comienzan a llenar un subnivel cuando se ha completado el anterior.
Ejemplo 1: El sodio (Na) con Z = 11
Na: 1s2 2s2 2p6 3s1
Al sumar todos los exponentes, el total será el número atómico, en este caso Z = 11.
El último nivel de energía es n = 3.
Al último nivel de energía se le conoce como capa de valencia; los electrones que se ubican
en este nivel se les llama electrones de valencia.
Capa de valencia = 3
Electrones de valencia = 1
Ejemplo 2: Utilizando el diagrama de la Figura 1: Diagrama de Möeller: es la distribución electrónica del
bromo con Z = 35
Br: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5
Capa de valencia: 4
Electrones de valencia: 7




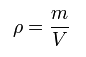







No hay comentarios:
Publicar un comentario