¿DE QUÉ ESTÁ HECHA LA MATERIA? LA MATERIA Y
SUS PROPIEDADES GENERALES Y ESPECÍFICAS
Todos los cuerpos del Universo están formados por materia. Ejemplos de
sistemas materiales son el aire de un globo, el agua en un vaso, un tronco de
madera, un trozo de hierro, un puñado de arena, etc.
Pero, ¿qué es la materia?
El aceite, el oxígeno, una roca de magnetita, son cuerpos materiales.
Sin embargo el calor, el frió, el sonido, el sabor, no son elementos
materiales.
Masa y volumen son las propiedades generales necesarias para poder
hablar de materia. Se puede definir como materia todo lo que tiene masa y ocupa
un lugar en el espacio. Es decir, la materia es todo aquello que presenta masa
y volumen.
La masa se define como la cantidad de materia de un cuerpo. Su unidad
de medida es el kg.
El volumen se define como el espacio que ocupa un cuerpo. Su unidad
de medida es el m3.
Por tanto, los sólidos, los líquidos y los gases son materia. Todos
ellos tienen masa y ocupan un volumen.
Diferentes elementos materiales: solido, líquido y gas.
Definiciones:
Materia: todo aquello que tiene masa y ocupa un espacio.
Sistema material: porción de materia considerada de forma aislada
para su estudio (por ejemplo, el gas contenido dentro de un globo, un cubito de
hielo, un trozo de hierro, etc.)
Sustancia: tipo concreto de materia de la que está formada un
determinado cuerpo.
PROPIEDADES DE LA MATERIA.
La materia presenta diferentes
propiedades, que se clasifican en generales (intensivas) y específicas
(extensivas).
Propiedades generales (intensivas)
de la materia: son propiedades que dependen de la cantidad de materia
considerada. Las presentan cualquier materia o sustancia, y no sirven para
diferenciar unas sustancias de otras. Ejemplos de propiedades generales son
masa, volumen, peso, longitud, etc.
Ejemplo: la masa es
una propiedad general, y no permite diferenciar sustancias: se pueden tener 5
Kg de hierro y 5Kg de hielo. La densidad es una propiedad específica, permite
diferenciar sustancias: la densidad del aluminio es 2,7 gr/cm3,
mientras que la densidad del mercurio es de 13
gr/cm3
MASA.
Se llama masa a la cantidad
de materia que tiene un cuerpo. Su unidad en el S.I. es el kilogramo (kg).
La masa de un cuerpo permanece
siempre igual, sin importar su temperatura ni cambios en su estado físico o su
forma geométrica.
La masa se mide con
la balanza, instrumento que compara la masa del cuerpo a medir con la unidad de
masa (1 Kg).
MASA Y PESO.
Hablando con propiedad, hay que
distinguir entre masa y peso. Masa es una medida de la cantidad de materia de
un objeto; peso es una medida de la fuerza gravitatoria que actúa sobre
el objeto.
Masa y
fuerza gravitatoria (peso) están íntimamente relacionadas. El científico inglés
Newton demostró que dos cuerpos cualesquiera ejercen entre sí una fuerza de
atracción, de forma que el valor de dicha fuerza depende de la distancia entre
ellos (a más distancia menos fuerza) y de la masa de cada uno (a más masa más
fuerza).Una característica de la fuerza gravitatoria entre dos cuerpos es que, en muchos casos, tiene un valor tan pequeño que resulta inapreciable, a no ser que al menos uno de los dos cuerpos tenga una masa enorme.
Pues bien, el peso es la fuerza gravitatoria con la que la Tierra atrae a cualquier cuerpo que se encuentre sobre ella, o a una determinada distancia (altura) de ella. Recordar que el peso será mayor cuanto mayor sea la masa del cuerpo, pero menor cuanto más alejado se encuentre el cuerpo de la superficie terrestre.
Por ello, y al contrario de lo que sucede con la masa, el peso de un cuerpo no es constante, sino que depende de su ubicación y distancia (por ejemplo, aunque la masa de un cuerpo es siempre la misma, el peso de ese cuerpo en la superficie de la Tierra no será igual al peso de ese mismo cuerpo en órbita alrededor de la Tierra, ni igual al peso de dicho cuerpo en Júpiter).
¿Cómo se calcula el peso de un cuerpo?
P = m · g
Para medir el peso de un cuerpo se utilizan unos instrumentos de medida llamados dinamómetros. Un dinamómetro es esencialmente un muelle situado sobre una escala calibrada que indica el peso en Newtons. Al colgar un objeto del muelle, éste se alargará más o menos dependiendo del peso del objeto.
Volumen es la cantidad de espacio que ocupa un cuerpo. La unidad de volumen en el S.I. es el metro cúbico (m3).
Al contrario que ocurría con la masa, el volumen de los cuerpos no permanece siempre constante:
1) El volumen de los sólidos y los líquidos depende de la temperatura.
Si la temperatura aumenta, los sólidos y los líquidos se dilatan; es decir, aumenta su volumen.
Si la temperatura disminuye, los sólidos y los líquidos se contraen; es decir, disminuye su volumen.
2) El volumen de los gases está muy fuertemente influenciado por la temperatura y la presión, y obedece unas leyes muy concretas (leyes de los gases ideales).
NOTA: Volumen y capacidad.
Volumen es el espacio que ocupa un cuerpo, mientras que capacidad el espacio vacío en un cuerpo (recipiente) que es necesario para contener una determinada sustancia u otros cuerpos. Así, el volumen de un vaso de cristal no viene dado por lo que cabe en el mismo (su capacidad), sino por el espacio que ocupa dicho cristal.
Sin embargo, volumen y capacidad están íntimamente relacionados, y las equivalencias entre sus unidades son:
Se define densidad (ρ) como la cantidad de masa presente en una sustancia por unidad de volumen en esa misma sustancia.
La masa y el volumen son propiedades generales de la materia, por lo que su valor sólo depende de la cantidad de sustancia tomada. Es decir, toda sustancia tiene masa y volumen, y pueden tomar cualquier valor, por lo que no son propiedades que permitan diferenciar unas sustancias de otras.
Ejemplos:
Hablando de masa, se puede tener una masa de 10 kg de mercurio y una masa de 10 kg de aire. De igual forma se pueden tener 20 kg de aluminio, igual que se pueden tener 500 kg de aluminio.
Para el volumen ocurre igual, se puede tener un volumen de 1 m3 de agua, y un volumen de 1 m3 de plomo. Así mismo puede haber 5 m3 de hidrógeno o 250 m3 de hidrógeno.
Sin embargo, la materia también presenta propiedades específicas, que toman valores concretos y específicos en función de la sustancia considerada.
Por todo ello, las propiedades específicas de la materia permiten diferenciar unas sustancias de otras, ya que toman un valor característico para cada sustancia o material determinado. Así, un punto de fusión de 960 ºC indica que el material es plata, mientras que un punto de fusión de 240 ºC corresponde al estaño.
Existen muchas propiedades específicas, tales como conductividad eléctrica, elasticidad, dureza, conductividad térmica, etc. En este tema nos centraremos únicamente en una de las más importantes: la densidad.
Actividades “propiedades de la materia”
RESPONDE:
1) ¿Se puede diferenciar una sustancia de otra midiendo su masa? ¿Y conociendo su volumen? ¿Y conociendo su dureza y conductividad?
2) Se somete a un mismo trozo de aluminio a los siguientes procesos: Calentarlo hasta que se haga totalmente líquido Pulverizarlo Colocarlo en órbita en el espacio Partirlo en dos pedazos iguales y dejar sólo uno de ellos. Llevarlo a Marte en una sonda espacial
¿En cuál o cuáles de los anteriores procesos variará su masa?
3) ¿Cuál es tu masa? ¿Y cuál es tu peso?
4) Señalad si las siguientes cuatro proposiciones son verdaderas (V) o falsas (F), explicando por qué.
a) 1 kg de plomo pesa más que 1 kg de paja
b) El peso se mide en kg
c) En el vacío los cuerpos no pesan.
d) Dentro del agua se pesa menos que fuera.
5)Expresad en litros: 1200 cm3; 1 m3; 250 mL. Expresad en cm3: 0’5 L; 1 m3; 2 dm3
La
Grecia antigua y su idea sobre la materia
Desde que
se descubrió el fuego, las diversas culturas lo han utilizado en múltiples
usos, pero en el avance tecnológico, un hito importante en el uso del fuego es
la fuente de calor para la obtención de metales.
Para
obtener cada metal se fue necesitando de un procedimiento más complejo: así
nació la metalurgia; se empieza a recurrir al uso de numerosas sustancias
químicas, pero el interés se centra en el producto final, en cómo conseguirlo y
sus principales aplicaciones.
Para la
gente de aquella época sería difícil explicar porque cuando se agrega estaño al
cobre se obtiene una aleación dura. Se sabe que al hacerlo, resulta un metal
más duro, pero desconocen las razones; el conocimiento empírico precedió el
conocimiento científico.
Desde la Grecia Clásica hasta Lavoisier
Con los
avances logrados en las primeras civilizaciones, el hombre dispuso de conocimientos
empíricos y descripciones de fenómenos que harían suponer el surgimiento de una
etapa superior, en la que el cuestionamiento de los hechos observados sería
cercano a lo que hoy llamamos el “racionamiento lógico” Por esto sabemos que
los griegos de la época clásica fueron famosos por sus aportes a diversas áreas
del conocimiento.
Entre ellas
la química, donde fueron legadas dos nociones muy importantes, tales es el
concepto de átomo y el de elemento, aunque solo en el
siglo XIX podrían adquirir el actual significado.
Composición de la materia
Para Tales
de Mileto la materia estaba compuesta por agua; para Amaximenes por aire; para
Heraclito de Efeso por fuego. Pero fue Empedocles de Agriento en Sicilia, quien
postuló la Teoría de los cuatro elementos: tierra, aire, agua y fuego, los
cuales estarían constituidos por minúsculas partículas. Esta doctrina fue
enriquecida por Aristóteles Estagira, y estuvo vigente, gracias a su gran
prestigio, hasta el siglo XVI y, ya solo parcialmente hasta el siglo XVIII.
Aristóteles
postulaba la existencia de una materia primaria, que llamo elemento, y cuatro
cualidades frío, calor, húmedo y seco. La combinación de dos cualidades daba
origen a la materia primaria, de la cual está hecho todo lo que nos rodea. Si
se combina lo seco con lo frío, se obtiene la tierra; lo frío con lo húmedo el
agua; lo húmedo con lo caliente el aire y lo caliente con lo seco el fuego.
Para
Demócrito, la materia está constituida por átomos que se mueven en el vacío en
forma continua y al azar. Además, los átomos tienen forma y tamaño, lo que
explica sus propiedades. Este planteamiento se asemeja bastante a uno de los
postulados de la actual Teoría Cinético Molecular que propone que todos los
cuerpos, con independencia de su estado físico, están formado por partículas
(átomos o moléculas) que están en continuo movimiento o vibrando.
Sin
embargo, prevaleció la teoría perfeccionada de los cuatro elementos, presentada
por Aristóteles, por el prestigio incuestionable del filósofo.
La Alquimia: una larga etapa
Este
periodo del desarrollo de la química parece iniciarse en Egipto, o Khem, la
tierra del suelo oscuro, y de allí podría derivar Al Khem (el arte del suelo
oscuro) que combina aspectos que van desde filosofía griega y artesanía
oriental hasta magia y misticismo religioso. Su principal objetivo se dice que
era la obtención de metales nobles, tales como oro y plata, a partir de metales
comunes, como estaño y plomo, trasmutándose por la piedra filosofal.
Entre los
siglos IV y V, los emigrantes llevaron sus conocimientos a los Árabes. Entre
los siglos VIII y XI se alcanzó un notable desarrollo de las ciencias en esta
región. Los conocimientos de los alquimistas Árabes fueron llevados a Europa
entre los siglos XI y XVI, a través de Sicilia y España.
El mayor
aporte de los alquimistas es el de los equipos y aparatos de laboratorio, las
técnicas experimentales y métodos para preparar numerosas especies químicas.
Algunos
alquimistas famosos fueron Geber, Avecina, Averroes, San Alberto Magno, Roger
Bacon, Raimundo Lulio.
Estructura atómica
Desde el siglo V a. de C. la humanidad ha escuchado
hablar de átomos, como las partículas fundamentales de la materia. Sin embargo,
debido a que los átomos son tan pequeños, no es posible verlos a simple vista,
por esta razón, se han propuesto varios modelos y teorías acerca de cómo son
estas partículas fundamentales. Veamos.
Los griegos fueron quienes por primera vez se
preocuparon por indagar sobre la constitución íntima de la materia, aunque
desde una perspectiva puramente teórica, pues no creían en la importancia de la
experimentación. Cerca del año 450 a. de C., Leucipo y su discípulo, Demócrito
(fi gura 1), propusieron que la materia estaba constituida por pequeñas
partículas a las que llamaron átomos, palabra que signifi ca indivisible. Los
postulados del atomismo griego establecían que:
■ Los átomos son sólidos.
■ Entre los átomos sólo existe el vacío.
■ Los átomos son indivisibles y eternos.
■ Los átomos de diferentes cuerpos difieren entre sí
por su forma, tamaño y distribución espacial.
■ Las propiedades de la materia varían según
el tipo de átomos y como estén agrupados.
“Cuando se forma un enlace químico los átomos reciben, ceden o comparten electrones de tal forma que la capa más externa de cada átomo contenga ocho electrones, y así adquiere la estructura electrónica del gas noble más cercano en el sistema periódico”.
No obstante, hay muchas excepciones a esta regla y hasta se han logrado sintetizar algunos compuestos de los gases nobles.
A.5. En 1962, el químico canadiense N. Bartlett logró con relevante éxito, obtener el primer verdadero compuesto del Xenon. Investiga ¿cuál fue este compuesto?
A.6. Realiza la configuración electrónica de los gases nobles y señala que coincidencias hay entre éstas. ¿Qué conducta podemos esperar de estos átomos con relación a la formación de enlaces químicos?
TEORÍA
ATÓMICA Y SU EVOLUCIÓN FILOSÓFICA Y CIENTÍFICA
Desde los tiempos de Tales de Mileto,
unos 600 años a. C., los filósofos griegos empezaron a hacer especulaciones
lógicas sobre el mundo físico, en lugar de confiar en los mitos para explicar
los fenómenos. El mismo Tales pensaba que toda la materia procedía del agua,
que podía solidificarse en tierra o evaporarse en aire. Sus sucesores ampliaron
esta teoría en la idea de que el mundo estaba compuesto por cuatro elementos:
tierra, agua, aire y fuego.
A medida que los científicos fueron
conociendo la estructura del átomo a través de experimentos, modificaron su
modelo atómico para ajustarse a los datos experimentales. El físico británico
Joseph John Thomson observó que los átomos contienen cargas negativas y
positivas, mientras que su compatriota Ernest Rutherford descubrió que la carga
positiva del átomo está concentrada en un núcleo. El físico danés Niels Bohr
propuso la hipótesis de que los electrones sólo describen órbitas en torno al
núcleo a determinadas distancias, y su colega austriaco Erwin Schrödinger
descubrió que, de hecho, los electrones de un átomo se comportan más como ondas
que como partículas y es lo que propone el modelo atómico.
ACTIVIDAD:
Lee con tus compañeros de grupo
atentamente la guía, y discute sobre los temas allí tratados resolviendo consignando
la información en tu cuaderno.
TALLER:
1) ¿Cuáles fueron los filósofos que
intentaron explicar cómo estaba compuesta la materia y que decían en sus
postulados o teorías?.
2) ¿Qué tipo de partículas
fundamentales se encuentran dentro del núcleo de un átomo y cual carga
eléctrica tienen según Rutherford?
3) ¿Qué tipo de partículas hay en el exterior
del núcleo de un átomo y que carga eléctrica tienen según la propuesta teórica
de Niels Bohr? Dibuje este modelo atómico.
4) ¿Qué fallas tuvo el modelo atómico
de Bohr y explique cómo se llegó al modelo actual del átomo?
Regla del octeto y estructura de Lewis
A inicios del siglo XX, en 1916, de manera independiente, los científicos Walter Kossel y Gilbert Lewis concluyeron que la tendencia que poseen los átomos de lograr estructuras similares a las del gas noble más cercano explica la formación de los enlaces químicos. Esta conclusión es mundialmente conocida como la Regla del Octeto y se enuncia de la siguiente manera:“Cuando se forma un enlace químico los átomos reciben, ceden o comparten electrones de tal forma que la capa más externa de cada átomo contenga ocho electrones, y así adquiere la estructura electrónica del gas noble más cercano en el sistema periódico”.
No obstante, hay muchas excepciones a esta regla y hasta se han logrado sintetizar algunos compuestos de los gases nobles.
A.5. En 1962, el químico canadiense N. Bartlett logró con relevante éxito, obtener el primer verdadero compuesto del Xenon. Investiga ¿cuál fue este compuesto?
- C.5. Fomentar el manejo de la bibliografía es muy importante cuando queremos formar investigadores con curiosidad científica, cuidando evitar las frustraciones que podrían resultar de no encontrar la información, por lo tanto es importante que esta se encuentre en los textos recomendados.
A.6. Realiza la configuración electrónica de los gases nobles y señala que coincidencias hay entre éstas. ¿Qué conducta podemos esperar de estos átomos con relación a la formación de enlaces químicos?
- C.6. Con esta actividad lograremos diagnosticar la captación de los conceptos: estabilidad y neutralidad eléctrica asociados a la regla del octeto. Es importante que quede bien establecido cuál es el tipo de estructura (gas noble) que se relaciona directamente con estabilidad atómica.
- C.7. Muchas veces los estudiantes olvidan, por que lo han visto en un curso previo, que las especies iónicas no contienen las mismas cantidades de electrones en su capa de valencia, por lo tanto esta práctica nos servirá para diagnosticar los niveles del grupo en cuanto al concepto de ion y ligarlo inmediatamente con la regla del octeto, enfatizando que estas especies no se forman por casualidad sino por una conveniencia: mayor estabilidad.
3.1 ¿Cómo diseñar una estructura de Lewis?
La estructura de Lewis permite ilustrar de manera sencilla los enlaces químicos, en ella, el símbolo del elemento está rodeado de puntos o pequeñas cruces que corresponden al número de electrones presentes en la capa de valencia.3.2 Parámetros a considerar en una estructura de Lewis
- Escribe el número total de electrones de valencia.
- Considera que cada enlace se formará a partir de dos, y solo dos, electrones.
- Cada átomo deberá cumplir con la regla del octeto. Excepto el hidrógeno que deberá tener solo 2 electrones para cumplir con la regla del dueto.




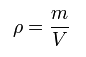












No hay comentarios:
Publicar un comentario